Dabei kommt den
Endothelzellen eine besondere Bedeutung zu. Als Bausteine der
Kapillaren haben sie direkten Kontakt zu den Organen. Erreicht die Endothelzellen ein Wachstumssignal aus dem mit Sauerstoff und Nährstoffen unterversorgten Gewebe, wechseln die Zellen innerhalb kurzer Zeit von einem Ruhezustand in einen Zustand mit beschleunigter
Zellteilungsaktivität. Dieser Umschaltprozess erfordert eine umfangreiche Anpassung ihres
Stoffwechsels, da genügend Energie und Bausteine für die Zellteilung bereitgestellt werden müssen.
Molekularer Schalter für Wachstum
Die Arbeitsgruppe von Michael Potente am Max-Planck-Institut für Herz- und Lungenforschung hat nun einen entscheidenden molekularen Schalter der Blutgefäßbildung entdeckt, der die Zellteilungs- und Stoffwechselaktivität von Endothelzellen koordiniert. Es handelt sich um den Transkriptionsfaktor FOXO1, der im Zellkern das Ablesen von Genen kontrolliert. „Als wir im Experiment in Mäusen FOXO1 durch einen genetischen Eingriff in Endothelzellen gezielt ausschalteten, führte dies zu einem unkontrollierten Wachstum der Gefäßzellen. Umgekehrt bremste das Anschalten des Moleküls das Blutgefäßwachstum“, sagt Potente. 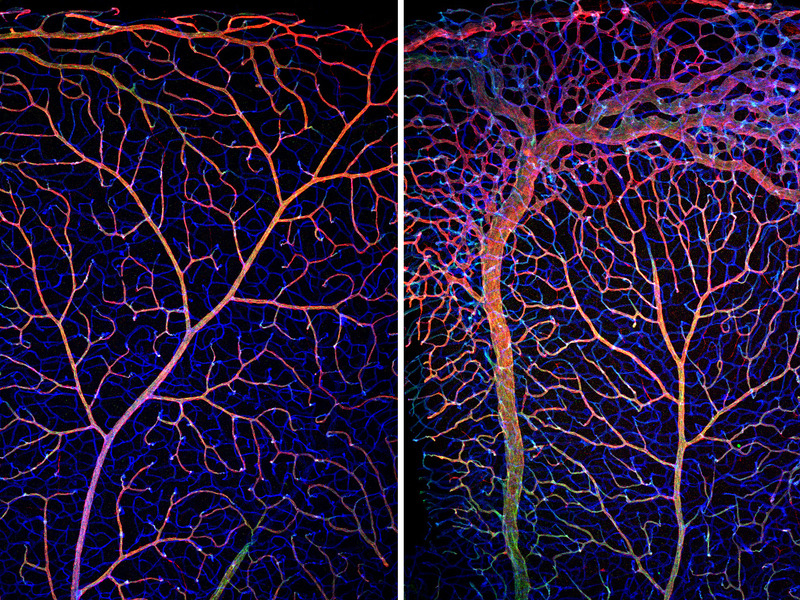 Sich entwickelnde Blutgefäße in der Netzhaut von Mäusen: Bei Kontrolltieren (links) weist das Gefäßnetzwerk einen hohen Organisationsgrad auf. Fehlt den Tieren das FOXO1-Gen, läßt sich ein überschießendes und anhaltendes Wachstum von Blutgefäßen beobachten. Insbesondere der venöse Teil des Gefäßnetzwerkes ist durch die genetische Inaktivierung von FOXO1 betroffen und durch eine Zunahme der Gefäßgröße und Dichte gekennzeichnet. Die Farben kennzeichnen verschiedene Blutgefäßmarker. © MPI für Herz- und Lungenforschung Zusammen mit europäischen und US-Kollegen fanden die Wissenschaftler Hinweise auf den zugrunde liegenden Mechanismus. Demnach verlangsamt FOXO1 die Stoffwechsel- und Zellteilungsaktivität in den Endothelzellen. „Unter normalen, physiologischen Zuständen verhindert FOXO1 so eine unkontrollierte Zellteilung, welche die Gefäßfunktion beeinträchtigen würde. Ist jedoch das Wachstum von Blutgefäßen nötig, erlaubt FOXO1 eine höhere
Sich entwickelnde Blutgefäße in der Netzhaut von Mäusen: Bei Kontrolltieren (links) weist das Gefäßnetzwerk einen hohen Organisationsgrad auf. Fehlt den Tieren das FOXO1-Gen, läßt sich ein überschießendes und anhaltendes Wachstum von Blutgefäßen beobachten. Insbesondere der venöse Teil des Gefäßnetzwerkes ist durch die genetische Inaktivierung von FOXO1 betroffen und durch eine Zunahme der Gefäßgröße und Dichte gekennzeichnet. Die Farben kennzeichnen verschiedene Blutgefäßmarker. © MPI für Herz- und Lungenforschung Zusammen mit europäischen und US-Kollegen fanden die Wissenschaftler Hinweise auf den zugrunde liegenden Mechanismus. Demnach verlangsamt FOXO1 die Stoffwechsel- und Zellteilungsaktivität in den Endothelzellen. „Unter normalen, physiologischen Zuständen verhindert FOXO1 so eine unkontrollierte Zellteilung, welche die Gefäßfunktion beeinträchtigen würde. Ist jedoch das Wachstum von Blutgefäßen nötig, erlaubt FOXO1 eine höhere
Stoffwechselaktivität der Zellen“, so Potente. Auf diese Weise können dann ausreichend zelluläre Bausteine für das expandierende Gefäßnetzwerk zur Verfügung gestellt werden. Ein Hinweis auf die Bedeutung von FOXO1 im Endothel ergibt sich aus der Tatsache, dass das Molekül in der Evolution hoch konserviert ist. „Vom Fadenwurm über Fruchtfliege bis zum Menschen lässt sich das Molekül finden. Die meisten Zelltypen besitzen das Protein“, sagte Potente. Dass es vor allem in Endothelzellen eine herausragende Funktion hat, liegt nach Potentes Ansicht an dem besonderen Stoffwechselumfeld, in dem diese Zellen angesiedelt sind. „Gefäßzellen sind im direkten Kontakt mit dem sauerstoff- und nährstoffreichen Blut und müssen diese Stoffe an das umliegende Gewebe abgeben.“ Dies macht eine optimale Regulation des Zellstoffwechsels notwendig.
Typisch bei bösartigen Tumoren
Nach Meinung der Max-Planck-Forscher könnte FOXO1 zukünftig eine wichtige Rolle bei der Behandlung verschiedener Erkrankungen spielen. So ist bekannt, dass FOXO1 häufig in Tumoren inaktiviert ist. Diese Inaktivierung könnte zu dem unkontrollierten Gefäßwachstum beitragen, das typisch für bösartige Tumoren ist. „Das Wachstum von Tumoren ließe sich möglicherweise mittels gezielter pharmakologischer Aktivierung von FOXO1 unter Kontrolle bringen“, spekuliert Potente. Auch bei Stoffwechselerkrankungen wie Diabetes mellitus könnte FOXO1 eine Rolle spielen. „Die dabei zu beobachtende Fehlfunktion des Gefäßwachstums ist womöglich auf eine gestörte Regulation von FOXO1 in den Endothelzellen zurückzuführen“, so Potente. Originalpublikation: FOXO1 couples metabolic activity and growth state in the vascular endothelium Kerstin Wilhelm et al.; Nature, doi: 10.1038/nature16498; 2015